DESCARGAR
VERSIÓN
ARTÍCULO
DESCARGAR
VERSIÓN
EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN
CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: personas con riesgo de parto pretérmino (PPT), con síntomas de PPT, o que hayan tenido PPT.
- Alcance: prevención y tratamiento de PPT.
Autores
Expertos clínicos:
- Omar Fernando Yanque Robles
- Jorge Eduardo Arroyo Campuzano
- César Hugo Rosales Cerrillo
- Jorge Alberto Mucho Lara
- Raúl César Alegría Guerrero
- Martina Leonila Zegarra Linares
- Marisol Olga Ramírez Linares
- Ana Cecilia Lino Salazar
- Pablo Ricardo Moreno Martínez
- Daniel Serafín Ramos Espinoza
- Manuel Alejandro Caballero Noriega
- Gastón Chumbipuma Salsavilca
Metodólogos:
- Jessica Zafra Tanaka
- Alvaro Taype Rondán
- Larissa Otero Vegas
- Alberto Martín Guerra García Campos
Coordinadores:
- Stefany Salvador Salvador
- Raúl Alonso Timaná Ruiz
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
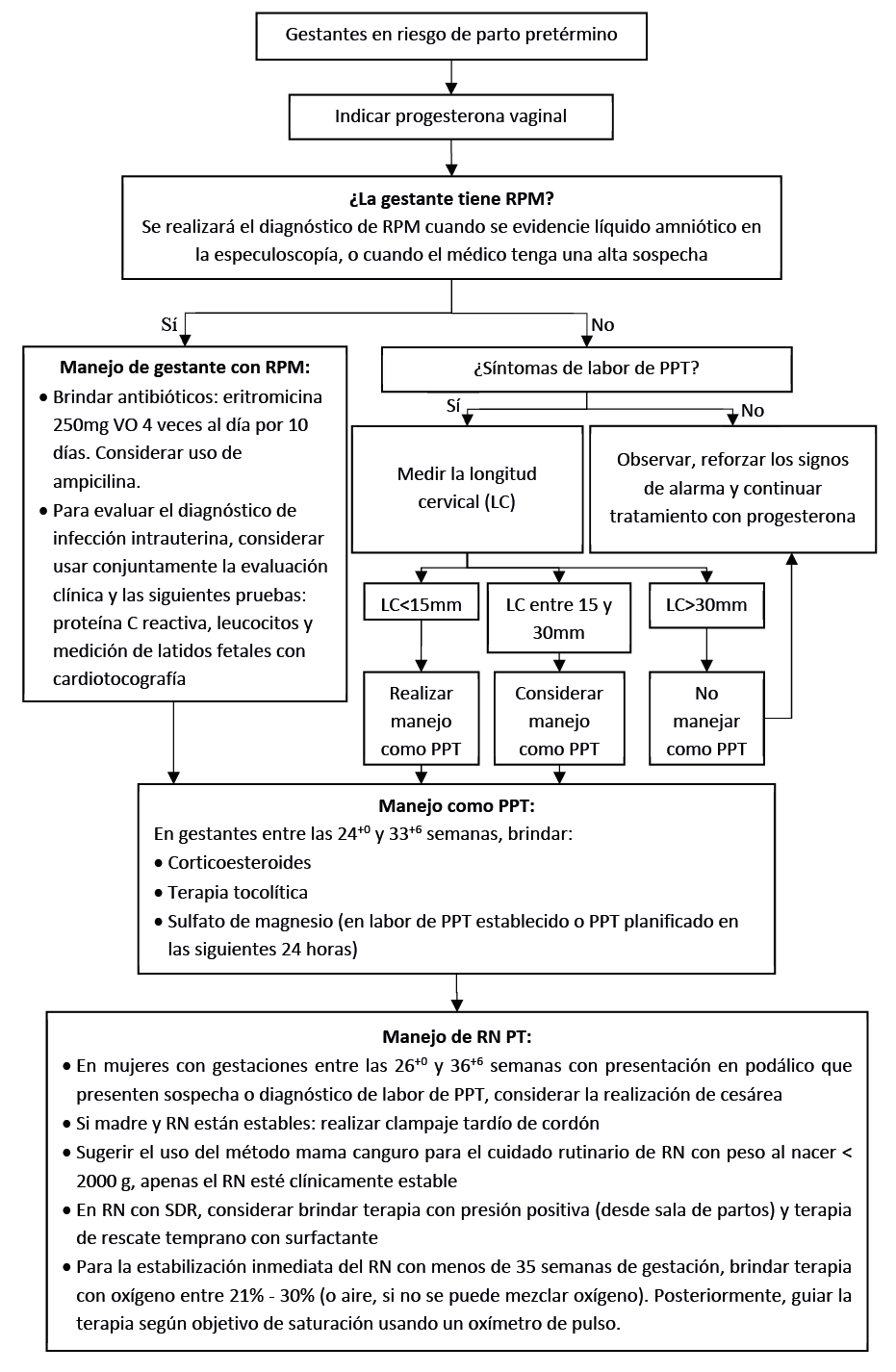
Flujogramas que resumen el contenido de la GPC
vacio
vacio
1. Prevención secundaria
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En gestantes asintomáticas con antecedente de PPT espontáneo, recomendamos indicar progesterona vaginal micronizada (200 mg, una vez al día [durante la noche] desde el inicio del segundo trimestre en adelante o por lo menos hasta la semana 34). (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 2:
En gestantes asintomáticas con cérvix corto identificado en ecografía transvaginal sugerimos progesterona vaginal micronizada (200 mg, una vez al día [durante la noche] desde el inicio del segundo trimestre en adelante o por lo menos hasta la semana 34). (Recomendación condicional a favor, certeza moderada de la evidencia)
BPC 1:
Brindar información y apoyo a gestantes con riesgo de PPT, sospecha de PPT, diagnóstico de PPT o en quienes haya sido necesario planear un PPT (así como a sus familiares), que incluya:
- Dar información oral y escrita
- Describir los síntomas y signos de la labor de PPT
- Explicar a la mujer el cuidado que se le podría ofrecer
- Dar información sobre probabilidad de sobrevida y otros riesgos a corto y largo plazo del RN, para lo cual se deberán expresar las cifras como frecuencias naturales (ej. 1 en 100)
- Informar sobre el cuidado de RN PT incluyendo el establecimiento de salud al cual debe acudir para su cuidado
- Informar sobre los problemas inmediatos que se pueden presentar en un RN PT
- Informar sobre las posibles consecuencias a largo plazo de la prematuridad (cómo crecen y se desarrollan los RN PT)
- Informar sobre cómo la gestante puede establecer su posición sobre la resucitación del RN. Fomentar constantemente posibilidad para hablar y realizar preguntas sobre el tema.
- Cuando sea posible, brindar la oportunidad de visitar la unidad de cuidados neonatales
- Brindar la oportunidad de hablar con un neonatólogo o pediatra.
- Considerar que la mujer (y su familia) pueden estar especialmente ansiosos
BPC 2:
La identificación del cérvix corto (<25mm) debería realizarse en la ecografía transvaginal del segundo trimestre, entre las 18 y 22 semanas de gestación.
2. Diagnóstico de RPM
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En gestantes con síntomas sugerentes de RPM pretérmino, realizar especuloscopía y, de observarse líquido amniótico, diagnosticar RPM pretérmino sin realizar otras pruebas para confirmar el diagnóstico de RPM.
BPC 2:
En las pacientes en quienes no se observa pérdida de líquido amniótico al examen con espéculo, se sugiere complementar con otras pruebas de ayuda diagnóstica, y manejar en base al criterio del médico tratante.
Es importante la evaluación para la inclusión de la disponibilidad de IGFBP-1 o PAMG-1 para su uso en EsSalud.
3. Antibióticos profilácticos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En gestantes en labor de PPT con membranas intactas sin signos clínicos de infección, recomendamos no administrar antibióticos de manera rutinaria. (Recomendación fuerte en contra, certeza moderada de la evidencia)
Recomendación 2:
En gestantes con RPM pretérmino recomendamos administrar antibióticos. (Recomendación fuerte a favor, certeza baja de la evidencia)
Recomendación 3:
En gestantes con RPM pretérmino sugerimos usar eritromicina como antibiótico de elección, a dosis de 250 mg vía oral cuatro veces por día, por diez días. (Recomendación condicional a favor, certeza moderada de la evidencia)
Recomendación 4:
En gestantes con RPM pretérmino recomendamos no usar la combinación de amoxicilina – ácido clavulánico. (Recomendación fuerte en contra, certeza moderada de la evidencia)
BPC 1:
En gestantes con RPM pretérmino, en quienes el médico tratante tenga sospecha bacteriológica que justifique añadir ampicilina, brindar combinación de ampicilina y eritromicina por lo menos durante dos días, seguido por amoxicilina y eritromicina oral.
BPC 2:
En gestantes con RPM pretérmino se debería monitorizar la presencia de signos de corioamnionitis y otras infecciones. Para ello, se debe combinar la evaluación clínica con proteína C reactiva, leucocitos y medición de latidos fetales con cardiotocografía. Tener en cuenta que cada prueba por separado no es suficiente para confirmar o excluir la infección intrauterina.
BPC 3:
Si los resultados de la evaluación clínica o cualquiera de las pruebas no son consistentes entre ellos, se deberá observar a la paciente y considerar repetir las pruebas.
4. Diagnóstico de PPT
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En gestantes con síntomas de labor de PPT (contracciones uterinas) y membranas intactas, recomendamos realizar ecografía transvaginal para medir la longitud cervical. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 2:
Si la longitud cervical es menor a 15mm, recomendamos seguir el protocolo de PPT. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 3:
Si la longitud cervical se encuentra entre 15 a 30mm, recomendamos considerar seguir el protocolo de PPT. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 4:
Si la longitud cervical es mayor a 30mm, sugerimos no seguir el protocolo de PPT. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
Las ecografías deben ser realizadas por profesional médico entrenado y con experiencia en medición de longitud cervical.
BPC 2:
En todas gestantes con sospecha de PPT y edad gestacional menor a 30 semanas, es preferible seguir el protocolo de PPT.
5. Corticosteroides
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres que tienen una edad gestacional confiable de 24+0 a 33+6 semanas, en quienes el PPT es considerado inminente y no haya evidencia clínica de infección, recomendamos brindar corticoides prenatales. (Recomendación fuerte a favor, certeza moderada de la evidencia)
Recomendación 2:
En mujeres que serán sometidas a parto abdominal en gestaciones pretérmino tardías (34+0 a 36+6 semanas), sugerimos no brindar corticoides prenatales. (Condicional en contra, certeza muy baja de la evidencia)
Recomendación 3:
Cuando se decida administrar corticoides prenatales, recomendamos brindar un ciclo de dexametasona intramuscular (IM) (6mg cada 12 horas hasta completar 4 dosis) o de betametasona IM (12mg cada 24 horas hasta completar 2 dosis). (Recomendación fuerte a favor, certeza baja de la evidencia)
Recomendación 4:
Si el PPT no ocurre 7 días después del primer ciclo completado de corticoides y una evaluación clínica posterior demuestra que hay riesgo de PPT en los siguientes 7 días, sugerimos una única repetición del ciclo de corticoides prenatales. (Recomendación condicional a favor, certeza baja de la evidencia)
BCP 1:
En mujeres elegibles, los corticoides prenatales deben ser administrados cuando el PPT se considere inminente en los próximos 7 días del inicio del tratamiento, incluso si se considera inminente en las próximas 24 horas.
6. Sulfato de magnesio
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con 24+0 a 29+6 semanas de gestación en labor de PPT establecido o PPT planificado en las siguientes 24 horas, recomendamos brindar sulfato de magnesio endovenoso. (Recomendación fuerte a favor, certeza baja de la evidencia)
Recomendación 2:
En mujeres con 30+0 a 33+6 semanas de gestación en labor de PPT establecido o PPT planificado en las siguientes 24 horas, sugerimos brindar sulfato de magnesio endovenoso. (Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
En los dos casos mencionados, la posología del sulfato de magnesio endovenoso será la siguiente: 4g en bolo en 15 minutos, seguido por 1g por hora hasta el nacimiento o por 24 horas (lo que suceda primero).
BPC 2:
En mujeres que están recibiendo sulfato de magnesio, monitorizar signos clínicos de toxicidad de magnesio por lo menos cada 4 horas, incluyendo reflejos profundos (ej. patelares), estado del sensorio, frecuencia cardíaca, frecuencia respiratoria, presión arterial y diuresis. Si la mujer tiene o desarrolla signos de toxicidad por sulfato de magnesio, monitorizar más frecuentemente la toxicidad y considerar reducir su dosis.
7. Tocolíticos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con amenaza de labor de PPT entre las 24+0 y 33+6 semanas, sugerimos brindar terapia tocolítica por 48 horas con la finalidad de procurar retrasar el parto, lo cual permitirá administrar terapia con corticoesteroides y/o transferir al tercer nivel. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BCP 1:
Los bloqueadores de canales de calcio (nifedipino) son los agentes tocolíticos de primera elección.
BCP 2:
Después de 48 horas de terapia tocolítica, no indique terapia de mantenimiento tocolítica con sulfato de magnesio, betamiméticos orales, antagonistas de oxitocina ni bloqueadores de canales de calcio. Sin embargo, puede considerar terapia tocolítica de mantenimiento con progesterona vía vaginal.
8. Cesárea o de parto vaginal
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En mujeres con gestaciones entre las 26+0 y 36+6 semanas con presentación en podálico que presenten sospecha o diagnóstico de labor de PPT, considerar la realización de cesárea.
9. Clampaje tardío de cordón
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Si la madre y el RN PT están estables, recomendarnos esperar por lo menos 30 segundos, pero no más de 3 minutos, antes de clampar el cordón. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
Si un RN PT debe ser alejado de la madre para resucitación o hay sangrado materno significativo o cualquier otra emergencia que lo amerite, considerar ordeñar y clampar el cordón lo antes posible.
BPC 2:
Posicionar al RN a la altura de o por debajo de la placenta antes de clampar el cordón.
BPC 3:
Como parte del cuidado de RN con peso al nacer < 2000 g, sugerir el uso del método de “mamá canguro” apenas el RN esté clínicamente estable. Si no es posible realizar este método de “manera continuada”, también es útil realizarlo de “manera intermitente”.
BPC 4:
Si el RN con peso al nacer < 2000 g no puede recibir el método de “mamá canguro”, brindarle atención en un ambiente termo-neutral, ya sea con radiadores de calefacción o incubadoras.
BPC 5:
Durante la estabilización y transferencia del RN PT de 32 semanas o menos a unidades especializadas, envolverlo con cobertor plástico para prevenir hipotermia.
10. Terapia con presión positiva continua
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Para el manejo de RN PT con SDR, recomendamos brindar terapia con presión positiva continua en vía aérea desde sala de partos. (Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
La terapia con presión positiva continua en vía aérea debe iniciarse tan pronto como se haga el diagnóstico de SDR en RN PT.
BPC 2:
Considerar administrar terapia de reemplazo con surfactante de rescate temprano (derivado de animales o sintéticos con proteínas) en las primeras 2 horas después del parto en RN PT con SDR, cuando sean atendidos en establecimientos de salud con capacidad de manejo.
BPC 3:
No se debe administrar surfactante de manera profiláctica (antes del inicio del SDR en RN PT).
11. Terapia con presión positiva continua
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Para la estabilización inmediata del RN de 35 semanas de gestación o menos, recomendamos usar terapia con oxígeno entre 21% – 30% (o aire, si no se puede mezclar oxígeno). (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
Posteriormente, la terapia con oxígeno se guiará según objetivo de saturación usando un oximetro de pulso.
Referencias bibliográficas
- Beck S, Wojdyla D, Say L, Betran AP, Merialdi M, Requejo JH, et al. The worldwide incidence of preterm birth: a systematic review of maternal mortality and morbidity. Bulletin of the World Health Organization. 2010;88:31-8.
- Blencowe H, Cousens S, Oestergaard MZ, Chou D, Moller A-B, Narwal R, et al. National, regional, and worldwide estimates of preterm birth rates in the year 2010 with time trends since 1990 for selected countries: a systematic analysis and implications. The Lancet. 2012;379(9832):2162-72.
- Escobar GJ, McCormick MC, Zupancic JA, Coleman-Phox K, Armstrong MA, Greene JD, et al. Unstudied infants: outcomes of moderately premature infants in the neonatal intensive care unit. Archives of Disease in Childhood-Fetal and Neonatal Edition. 2006;91(4):F238-F44.
- Huang J, Zhang L, Kang B, Zhu T, Li Y, Zhao F, et al. Association between perinatal hypoxic-ischemia and periventricular leukomalacia in preterm infants: A systematic review and meta-analysis. PloS one. 2017;12(9):e0184993.
- Iams JD, Romero R, Culhane JF, Goldenberg RL. Primary, secondary, and tertiary interventions to reduce the morbidity and mortality of preterm birth. The lancet. 2008;371(9607):164-75.
- Centro Nacional de Epidemiología Prevención y Control de Enfermedades del Ministerio de Salud. Boletín Epidemiológico del Perú Vol 26 – SE 49 2017 [Available from: http://www.dge.gob.pe/portal/docs/vigilancia/boletines/2017/49.pdf.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Mesiano S, Weatherborn M. Rationale for Current and Future Progestin-Based Therapies to Prevent Preterm Birth. Best Practice & Research Clinical Obstetrics & Gynaecology. 2018.
- Ehsanipoor RM, Seligman NS, Saccone G, Szymanski LM, Wissinger C, Werner EF, et al. Physical examination–indicated cerclage: a systematic review and meta-analysis. Obstetrics & Gynecology. 2015;126(1):125-35.
- Dodd JM, Jones L, Flenady V, Cincotta R, Crowther CA. Prenatal administration of progesterone for preventing preterm birth in women considered to be at risk of preterm birth. The Cochrane Library. 2013.
- Romero R, Nicolaides K, Conde-Agudelo A, Tabor A, O’brien JM, Cetingoz E, et al. Vaginal progesterone in women with an asymptomatic sonographic short cervix in the midtrimester decreases preterm delivery and neonatal morbidity: a systematic review and metaanalysis of individual patient data. American Journal of Obstetrics & Gynecology. 2012;206(2):124. e1-. e19.
- Bimbashi A, Ndoni E, Dokle A. Progesterone for prevention of preterm birth. Journal of Perinatal Medicine. 2013;41:783.
- Saleh Gargari S, Habibolahi M, Zonobi Z, Khani Z, Sarfjoo FS, Kazemi Robati A, et al. Outcome of vaginal progesterone as a tocolytic agent: randomized clinical trial. ISRN obstetrics and gynecology. 2012;2012.
- Palacio M, Cobo T, Antolín E, Ramirez M, Cabrera F, Mozo de Rosales F, et al. Vaginal progesterone as maintenance treatment after an episode of preterm labour (PROMISE) study: a multicentre, double‐blind, randomised, placebo‐controlled trial. BJOG: An International Journal of Obstetrics & Gynaecology. 2016;123(12):1990-9.
- Conde-Agudelo A, Romero R, Nicolaides K, Chaiworapongsa T, O’brien JM, Cetingoz E, et al. Vaginal progesterone vs cervical cerclage for the prevention of preterm birth in women with a sonographic short cervix, previous preterm birth, and singleton gestation: a systematic review and indirect comparison metaanalysis. American Journal of Obstetrics & Gynecology. 2013;208(1):42. e1-. e18.
- Romero R, Nicolaides K, Conde‐Agudelo A, O’Brien JM, Cetingoz E, Da Fonseca E, et al. Vaginal progesterone decreases preterm birth≤ 34 weeks of gestation in women with a singleton pregnancy and a short cervix: an updated meta‐analysis including data from the OPPTIMUM study. Ultrasound in Obstetrics & Gynecology. 2016;48(3):308-17.
- Norman JE, Marlow N, Messow C-M, Shennan A, Bennett PR, Thornton S, et al. Vaginal progesterone prophylaxis for preterm birth (the OPPTIMUM study): a multicentre, randomised, double-blind trial. The lancet. 2016;387(10033):2106-16.
- Alfirevic Z, Stampalija T, Roberts D, Jorgensen AL. Cervical stitch (cerclage) for preventing preterm birth in singleton pregnancy. Cochrane database of systematic reviews. 2011;4.
- Berghella V, Rafael TJ, Szychowski JM, Rust OA, Owen J. Cerclage for short cervix on ultrasonography in women with singleton gestations and previous preterm birth: a meta-analysis. Obstetrics & Gynecology. 2011;117(3):663-71.
- Otsuki K, Nakai A, Matsuda Y, Shinozuka N, Kawabata I, Makino Y, et al. Randomized trial of ultrasound‐indicated cerclage in singleton women without lower genital tract inflammation. Journal of Obstetrics and Gynaecology Research. 2016;42(2):148-57.
- Gupton A, Heaman M. Learning needs of hospitalized women at risk for preterm birth. Applied Nursing Research. 1994;7(3):118-24.
- Gaucher N, Payot A. From powerlessness to empowerment: Mothers expect more than information from the prenatal consultation for preterm labour. Paediatrics & child health. 2011;16(10):638-42.
- Griffin T, Kavanaugh K, Soto CF, White M. Parental evaluation of a tour of the neonatal intensive care unit during a high-risk pregnancy. Journal of Obstetric, Gynecologic & Neonatal Nursing. 1997;26(1):59-65.
- Sawyer A, Rabe H, Abbott J, Gyte G, Duley L, Ayers S, et al. Parents’ experiences and satisfaction with care during the birth of their very preterm baby: a qualitative study. BJOG: An International Journal of Obstetrics & Gynaecology. 2013;120(5):637-43.
- Young E, Tsai E, O’Riordan A. A qualitative study of predelivery counselling for extreme prematurity. Paediatrics & child health. 2012;17(8):432-6.
- Oakley A, Rajan L, Grant A. Social support and pregnancy outcome. BJOG: An International Journal of Obstetrics & Gynaecology. 1990;97(2):155-62.
- Villar J, Farnot U, Barros F, Victora C, Langer A, Belizan JM. A randomized trial of psychosocial support during high-risk pregnancies. New England Journal of Medicine. 1992;327(18):1266-71.
- Salomon L, Alfirevic Z, Berghella V, Bilardo C, Hernandez‐Andrade E, Johnsen S, et al. Practice guidelines for performance of the routine mid‐trimester fetal ultrasound scan. Ultrasound in Obstetrics & Gynecology. 2011;37(1):116-26.
- Tchirikov M, Schlabritz-Loutsevitch N, Maher J, Buchmann J, Naberezhnev Y, Winarno AS, et al. Mid-trimester preterm premature rupture of membranes (PPROM): etiology, diagnosis, classification, international recommendations of treatment options and outcome. Journal of perinatal medicine. 2017.
- Jain K, Morris PG. A clinical study to evaluate the usefulness of the MAST test in diagnosing pre-labour rupture of membranes. Journal of Obstetrics and Gynaecology. 1998;18(1):33-6.
- Tagore S, Kwek K. Comparative analysis of insulin-like growth factor binding protein-1 (IGFBP-1), placental alpha-microglobulin-1 (PAMG-1) and nitrazine test to diagnose premature rupture of membranes in pregnancy. J Perinat Med. 2010;38(6):609-12.
- Palacio M, Kuhnert M, Berger R, Larios CL, Marcellin L. Meta-analysis of studies on biochemical marker tests for the diagnosis of premature rupture of membranes: comparison of performance indexes. BMC pregnancy and childbirth. 2014;14:183.
- Khooshideh M, Radi V, Hosseini R, Hosseini L. The accuracy of placental alpha-microglobuline-1 test in diagnosis of premature rupture of the membranes. Iranian journal of reproductive medicine. 2015;13(6):355-60.
- Eleje GU, Ezugwu EC, Eke AC, Ikechebelu JI, Ezeama CO, Ezebialu IU, et al. Accuracy and response time of dual biomarker model of insulin-like growth factor binding protein-1/ alpha fetoprotein (Amnioquick duo+) in comparison to placental alpha-microglobulin-1 test in diagnosis of premature rupture of membranes. The journal of obstetrics and gynaecology research. 2017;43(5):825-33.
- Kenyon S, Boulvain M, Neilson JP. Antibiotics for preterm rupture of membranes. The Cochrane database of systematic reviews. 2013(12):Cd001058.
- Lee J, Romero R, Kim SM, Chaemsaithong P, Yoon BH. A new antibiotic regimen treats and prevents intra-amniotic inflammation/infection in patients with preterm PROM. The journal of maternal-fetal & neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstet. 2016;29(17):2727-37.
- Flenady V, Hawley G, Stock OM, Kenyon S, Badawi N. Prophylactic antibiotics for inhibiting preterm labour with intact membranes. The Cochrane database of systematic reviews. 2013(12):Cd000246.
- Kenyon SL, Taylor DJ, Tarnow-Mordi W. Broad-spectrum antibiotics for spontaneous preterm labour: the ORACLE II randomised trial. ORACLE Collaborative Group. Lancet (London, England). 2001;357(9261):989-94.
- Saccone G, Berghella V. Antibiotic prophylaxis for term or near-term premature rupture of membranes: metaanalysis of randomized trials. American journal of obstetrics and gynecology. 2015;212(5):627.e1-9.
- Wojcieszek AM, Stock OM, Flenady V. Antibiotics for prelabour rupture of membranes at or near term. The Cochrane database of systematic reviews. 2014(10):Cd001807.
- Thinkhamrop J, Hofmeyr GJ, Adetoro O, Lumbiganon P, Ota E. Antibiotic prophylaxis during the second and third trimester to reduce adverse pregnancy outcomes and morbidity. The Cochrane database of systematic reviews. 2015(6):Cd002250.
- Walss Rodriguez RJ, Navarro Castanon J. [Prophylactic antibiotics in premature rupture of the membranes]. Ginecologia y obstetricia de Mexico. 1988;56:339-42.
- Farmacia Institucional DIGEMID. Lista de Precios 02 de abril de 2018. [Available from: http://www.digemid.minsa.gob.pe/UpLoad/UpLoaded/PDF/LISTADO_MEDICAMENTOS_FARMACIA_INSTITUCIONAL_DIGEMID.pdf
- Obstetricians ACo, Gynecologists. Practice Bulletin No. 172: Premature Rupture of Membranes. Obstetrics and gynecology. 2016;128(4):e165.
- Higgins RD, Saade G, Polin RA, Grobman WA, Buhimschi IA, Watterberg K, et al. Evaluation and Management of Women and Newborns With a Maternal Diagnosis of Chorioamnionitis: Summary of a Workshop. Obstetrics and gynecology. 2016;127(3):426-36.
- Sanchez-Ramos L, Delke I, Zamora J, Kaunitz AM. Fetal fibronectin as a short-term predictor of preterm birth in symptomatic patients: a meta-analysis. Obstetrics and gynecology. 2009;114(3):631-40.
- Di Renzo GC. The great obstetrical syndromes. The journal of maternal-fetal & neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstet. 2009;22(8):633-5.
- Boots AB, Sanchez-Ramos L, Bowers DM, Kaunitz AM, Zamora J, Schlattmann P. The short-term prediction of preterm birth: a systematic review and diagnostic metaanalysis. American journal of obstetrics and gynecology. 2014;210(1):54.e1-.e10.
- Liggins GC, Howie RN. A controlled trial of antepartum glucocorticoid treatment for prevention of the respiratory distress syndrome in premature infants. Pediatrics. 1972;50(4):515-25.
- Schmitz T. [Prevention of preterm birth complications by antenatal corticosteroid administration]. Journal de gynecologie, obstetrique et biologie de la reproduction. 2016;45(10):1399-417.
- Roberts D, Dalziel S. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. The Cochrane database of systematic reviews. 2006(3):Cd004454.
- Amiya RM, Mlunde LB, Ota E, Swa T, Oladapo OT, Mori R. Antenatal Corticosteroids for Reducing Adverse Maternal and Child Outcomes in Special Populations of Women at Risk of Imminent Preterm Birth: A Systematic Review and Meta-Analysis. PLoS One. 2016;11(2):e0147604.
- Sotiriadis A, Makrydimas G, Papatheodorou S, Ioannidis JP. Corticosteroids for preventing neonatal respiratory morbidity after elective caesarean section at term. The Cochrane database of systematic reviews. 2009(4):Cd006614.
- Brownfoot FC, Gagliardi DI, Bain E, Middleton P, Crowther CA. Different corticosteroids and regimens for accelerating fetal lung maturation for women at risk of preterm birth. The Cochrane database of systematic reviews. 2013(8):Cd006764.
- Crowther CA, McKinlay CJ, Middleton P, Harding JE. Repeat doses of prenatal corticosteroids for women at risk of preterm birth for improving neonatal health outcomes. The Cochrane database of systematic reviews. 2011(6):Cd003935.
- Roberts D, Brown J, Medley N, Dalziel S. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. 2017.
- Althabe F, Belizan JM, McClure EM, Hemingway-Foday J, Berrueta M, Mazzoni A, et al. A population-based, multifaceted strategy to implement antenatal corticosteroid treatment versus standard care for the reduction of neonatal mortality due to preterm birth in low-income and middle-income countries: the ACT cluster-randomised trial. Lancet (London, England). 2015;385(9968):629-39.
- Marret S, Doyle LW, Crowther CA, Middleton P. Antenatal magnesium sulphate neuroprotection in the preterm infant. Seminars in fetal & neonatal medicine. 2007;12(4):311-7.
- Costantine MM, Drever N. Antenatal exposure to magnesium sulfate and neuroprotection in preterm infants. Obstetrics and gynecology clinics of North America. 2011;38(2):351-66, xi.
- Hirtz DG, Weiner SJ, Bulas D, DiPietro M, Seibert J, Rouse DJ, et al. Antenatal Magnesium and Cerebral Palsy in Preterm Infants. The Journal of pediatrics. 2015;167(4):834-9.e3.
- Turitz AL, Too GT, Gyamfi-Bannerman C. Proximity of magnesium exposure to delivery and neonatal outcomes. American journal of obstetrics and gynecology. 2016;215(4):508.e1-6.
- Drassinower D, Friedman AM, Levin H, Obican SG, Gyamfi-Bannerman C. Does magnesium exposure affect neonatal resuscitation? American journal of obstetrics and gynecology. 2015;213(3):424.e1-5.
- Haas DM, Imperiale TF, Kirkpatrick PR, Klein RW, Zollinger TW, Golichowski AM. Tocolytic therapy: a meta-analysis and decision analysis. Obstetrics and gynecology. 2009;113(3):585-94.
- Simhan HN, Caritis SN. Prevention of preterm delivery. The New England journal of medicine. 2007;357(5):477-87.
- Colon I, Berletti M, Garabedian MJ, Wilcox N, Williams K, El-Sayed YY, et al. Randomized, Double-Blinded Trial of Magnesium Sulfate Tocolysis versus Intravenous Normal Saline for Preterm Nonsevere Placental Abruption. American journal of perinatology. 2016;33(7):696-702.
- Nijman TAJ, Goedhart MM, Naaktgeboren CN, de Haan TR, Vijlbrief DC, Mol BW, et al. The effects of nifedipine and atosiban on perinatal brain injury: a secondary analysis of the APOSTEL III trial. Ultrasound in obstetrics & gynecology : the official journal of the International Society of Ultrasound in Obstetrics and Gynecology. 2017.
- Caliskan S, Narin MA, Dede FS, Narin R, Dede H, Kandemir O. Glyceryl trinitrate for the treatment of preterm labor. Journal of the Turkish German Gynecological Association. 2015;16(3):174-8.
- Wood S, Rabi Y, Tang S, Brant R, Ross S. Progesterone in women with arrested premature labor, a report of a randomised clinical trial and updated meta-analysis. BMC pregnancy and childbirth. 2017;17(1):258.
- Alavi A, Rajaee M, Amirian M, Mahboobi H, Jahanshahi KA, Faghihi A. Effect of Maintenance Therapy with Isoxsuprine in the Prevention of Preterm Labor: Randomized controlled trial. Electronic physician. 2015;7(4):1144-9.
- Hernandez WR, Francisco RPV, Bittar RE, Gomez UT, Zugaib M, Brizot ML. Effect of vaginal progesterone in tocolytic therapy during preterm labor in twin pregnancies: Secondary analysis of a placebo-controlled randomized trial. The journal of obstetrics and gynaecology research. 2017;43(10):1536-42.
- van Vliet EOG, Nijman TAJ, Schuit E, Heida KY, Opmeer BC, Kok M, et al. Nifedipine versus atosiban for threatened preterm birth (APOSTEL III): a multicentre, randomised controlled trial. Lancet (London, England). 2016;387(10033):2117-24.
- van Vliet E, Dijkema GH, Schuit E, Heida KY, Roos C, van der Post J, et al. Nifedipine maintenance tocolysis and perinatal outcome: an individual participant data meta-analysis. BJOG : an international journal of obstetrics and gynaecology. 2016;123(11):1753-60.
- Aggarwal A, Bagga R, Girish B, Kalra J, Kumar P. Effect of maintenance tocolysis with nifedipine in established preterm labour on pregnancy prolongation and neonatal outcome. Journal of obstetrics and gynaecology : the journal of the Institute of Obstetrics and Gynaecology. 2018;38(2):177-84.
- Verdurmen KMJ, Hulsenboom ADJ, van Laar J, Oei SG. Effect of tocolytic drugs on fetal heart rate variability: a systematic review. The journal of maternal-fetal & neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstet. 2017;30(20):2387-94.
- Haas DM, Caldwell DM, Kirkpatrick P, McIntosh JJ, Welton NJ. Tocolytic therapy for preterm delivery: systematic review and network meta-analysis. Bmj. 2012;345:e6226.
- Goldenberg RL, Nelson KG. The unanticipated breech presentation in labor. Clinical obstetrics and gynecology. 1984;27(1):95-105.
- Reddy UM, Zhang J, Sun L, Chen Z, Raju TN, Laughon SK. Neonatal mortality by attempted route of delivery in early preterm birth. American journal of obstetrics and gynecology. 2012;207(2):117.e1-8.
- Bergenhenegouwen L, Meertens L, Schaaf J, Nijhuis J, Mol B, Kok M, et al. Vaginal delivery versus caesarean section in preterm breech delivery: a systematic review. European Journal of Obstetrics & Gynecology and Reproductive Biology. 2014;172:1-6.
- Alfirevic Z, Milan SJ, Livio S. Caesarean section versus vaginal delivery for preterm birth in singletons. The Cochrane database of systematic reviews. 2013(9):Cd000078.
- Zlatnik FJ. The Iowa premature breech trial. American journal of perinatology. 1993;10(1):60-3.
- Wallace RL, Schifrin BS, Paul RH. The delivery route for very-low-birth-weight infants. A preliminary report of a randomized, prospective study. The Journal of reproductive medicine. 1984;29(10):736-40.
- Viegas OA, Ingemarsson I, Sim LP, Singh K, Cheng M, Ratnam SS, et al. Collaborative study on preterm breeches: vaginal delivery versus caesarean section. Asia-Oceania journal of obstetrics and gynaecology. 1985;11(3):349-55.
- Penn ZJ, Steer PJ, Grant A. A multicentre randomised controlled trial comparing elective and selective caesarean section for the delivery of the preterm breech infant. British journal of obstetrics and gynaecology. 1996;103(7):684-9.
- Backes CH, Rivera BK, Haque U, Bridge JA, Smith CV, Hutchon DJ, et al. Placental transfusion strategies in very preterm neonates: a systematic review and meta-analysis. Obstetrics and gynecology. 2014;124(1):47-56.
- Rabe H, Diaz-Rossello JL, Duley L, Dowswell T. Effect of timing of umbilical cord clamping and other strategies to influence placental transfusion at preterm birth on maternal and infant outcomes. The Cochrane database of systematic reviews. 2012(8):Cd003248.
- March MI, Hacker MR, Parson AW, Modest AM, de Veciana M. The effects of umbilical cord milking in extremely preterm infants: a randomized controlled trial. Journal of perinatology : official journal of the California Perinatal Association. 2013;33(10):763-7.
- Elimian A, Goodman J, Escobedo M, Nightingale L, Knudtson E, Williams M. Immediate compared with delayed cord clamping in the preterm neonate: a randomized controlled trial. Obstetrics and gynecology. 2014;124(6):1075-9.
- Ranjit T, Nesargi S, Rao PN, Sahoo JP, Ashok C, Chandrakala BS, et al. Effect of early versus delayed cord clamping on hematological status of preterm infants at 6 wk of age. Indian journal of pediatrics. 2015;82(1):29-34.
- de Almeida MF, Guinsburg R, Sancho GA, Rosa IR, Lamy ZC, Martinez FE, et al. Hypothermia and early neonatal mortality in preterm infants. The Journal of pediatrics. 2014;164(2):271-5.e1.
- Miller SS, Lee HC, Gould JB. Hypothermia in very low birth weight infants: distribution, risk factors and outcomes. Journal of perinatology : official journal of the California Perinatal Association. 2011;31 Suppl 1:S49-56.
- Conde-Agudelo A, Diaz-Rossello JL. Kangaroo mother care to reduce morbidity and mortality in low birthweight infants. The Cochrane database of systematic reviews. 2016(8):Cd002771.
- Flenady VJ, Woodgate PG. Radiant warmers versus incubators for regulating body temperature in newborn infants. The Cochrane database of systematic reviews. 2003(4):Cd000435.
- Oatley HK, Blencowe H, Lawn JE. The effect of coverings, including plastic bags and wraps, on mortality and morbidity in preterm and full-term neonates. Journal of perinatology : official journal of the California Perinatal Association. 2016;36 Suppl 1:S83-9.
- Respiratory support in preterm infants at birth. Pediatrics. 2014;133(1):171-4.
- Suresh GK, Soll RF. Overview of surfactant replacement trials. Journal of perinatology : official journal of the California Perinatal Association. 2005;25 Suppl 2:S40-4.
- Ho JJ, Subramaniam P, Henderson-Smart DJ, Davis PG. Continuous distending pressure for respiratory distress syndrome in preterm infants. The Cochrane database of systematic reviews. 2002(2):Cd002271.
- Dawson JA, Kamlin CO, Vento M, Wong C, Cole TJ, Donath SM, et al. Defining the reference range for oxygen saturation for infants after birth. Pediatrics. 2010;125(6):e1340-7.
- Cummings JJ, Polin RA. Noninvasive Respiratory Support. Pediatrics. 2016;137(1).
- Wyckoff MH, Aziz K, Escobedo MB, Kapadia VS, Kattwinkel J, Perlman JM, et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2015;132(18 Suppl 2):S543-60.
- Brown JV, Moe-Byrne T, Harden M, McGuire W. Lower versus higher oxygen concentration for delivery room stabilisation of preterm neonates: systematic review. PLoS One. 2012;7(12):e52033.
- Wyckoff MH, Aziz K, Escobedo MB, Kapadia VS, Kattwinkel J, Perlman JM, et al. Part 13: neonatal resuscitation: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2015;132(18 suppl 2):S543-S60.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo a ietsi.gpc@gmail.com

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com