GUÍA PRÁCTICA CLÍNICA:
PARA EL MANEJO DE LA DESNUTRICIÓN O EL RIESGO DE
DESNUTRICIÓN EN EL ADULTO (2021)
DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: adultos con desnutrición o riesgo de desnutrición.
- Alcance: manejo de la desnutrición o riesgo de desnutrición en adultos.
Autores
Expertos clínicos:
- Holguín Marín, Rosario Angela
Hospital Nacional Edgardo Rebagliati Martins. EsSalud. - Acosta Huertas, Antonio Fernando
Hospital Nacional Guillermo Almenara Irigoyen. EsSalud. - Carrillo Valverde, Maria Elena
Gerencia de Oferta Flexible – Atención domiciliaria. EsSalud. - De Stefano Beltrán, Raúl Mario
Gerencia Central de la Persona Adulta Mayor y Persona con Discapacidad. EsSalud. - Ferreyra Mujica, Mario Eugenio
Hospital Nacional Edgardo Rebagliati Martins. EsSalud. - Gómez Luján, Martín Jesús
Hospital Nacional Edgardo Rebagliati Martins. EsSalud. - Guerrero Muñoz, Luisa Angélica
Hospital Nacional Edgardo Rebagliati Martins. EsSalud. - Najarro Oriondo, Rosa Maximiliana
Hospital Nacional Alberto Sabogal Sologuren. EsSalud. - Quispe Arbildo, Diana
Hospital Nacional Alberto Sabogal Sologuren. EsSalud. - Soto Cochón, Carlina Roxana
Hospital Nacional Edgardo Rebagliati Martins. EsSalud. - Valdez Narbasta, Angelina del Pilar
Hospital Nacional Guillermo Almenara Irigoyen. EsSalud. - Verástegui Sayers, Teresa Zoraida
Hospital Nacional Guillermo Almenara Irigoyen. EsSalud.
Metodólogos:
- Dolores Maldonado, Gandy Kerlin
Instituto de Evaluación de Tecnologías en Salud e Investigación. EsSalud. - Delgado Flores Carolina Jaqueline
Instituto de Evaluación de Tecnologías en Salud e Investigación. EsSalud.
Coordinadores:
- Stefany Salvador Salvador
Instituto de Evaluación de Tecnologías en Salud e Investigación, EsSalud - Lourdes Carrera Acosta
Instituto de Evaluación de Tecnologías en Salud e Investigación, EsSalud
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
vacio
vacio
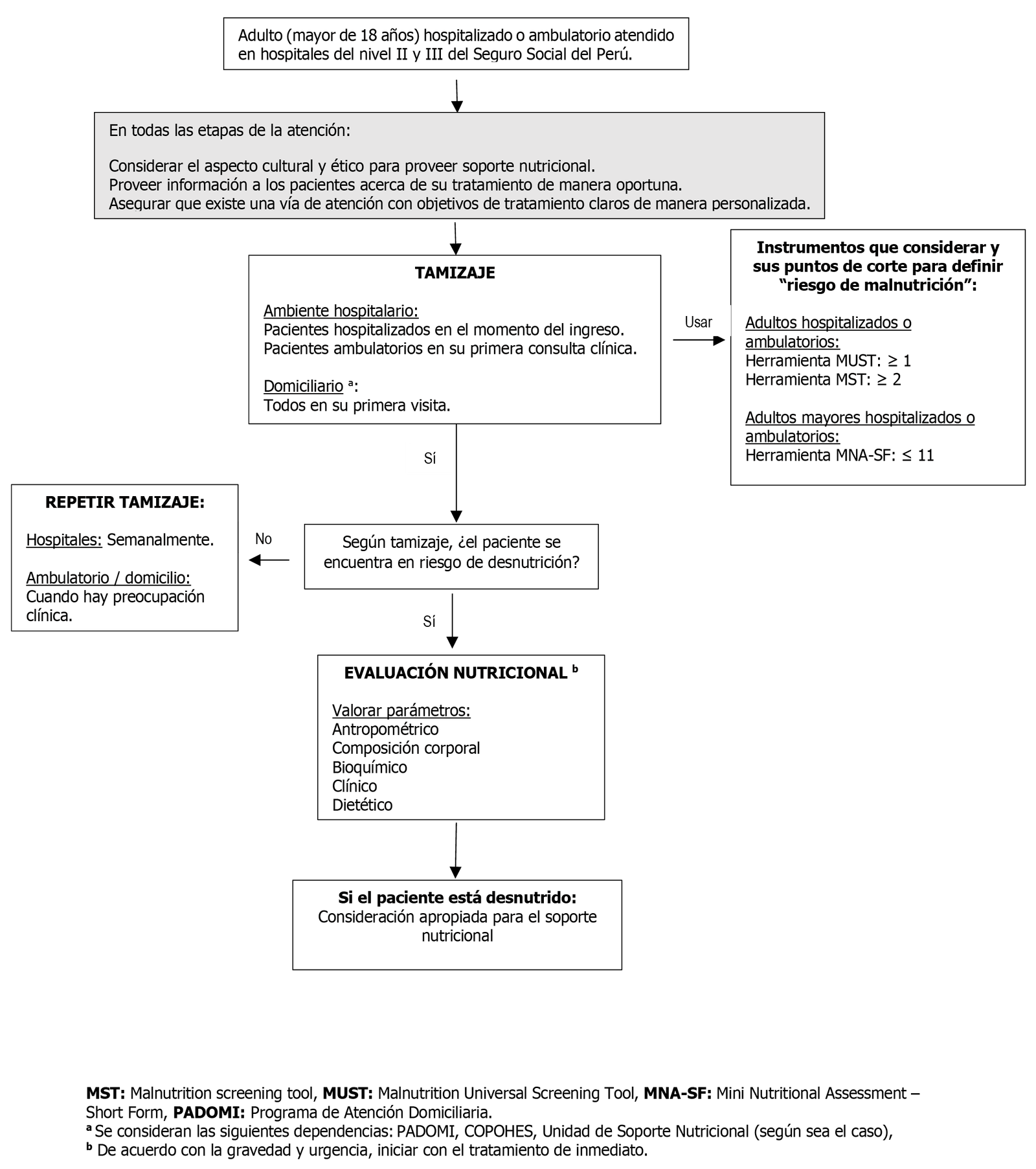
1. Tamizaje de desnutrición
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En pacientes adultos hospitalizados, realizar el tamizaje de riesgo nutricional dentro de las 24 a 48 horas después del ingreso del paciente.
En los pacientes adultos ambulatorios, que acudan a los hospitales niveles II y III, realizar el tamizaje para detectar el riesgo de desnutrición en la primera cita clínica.
BPC 2:
En pacientes adultos ambulatorios u hospitalizados, para realizar el tamizaje de riesgo de desnutrición, considerar usar (según factibilidad y experiencia) alguna de estas dos herramientas: “Malnutrition Screening Tool (MST)” o “Malnutrition Universal Screening Tool (MUST)”. Asimismo, para adultos mayores de 60 años, considerar usar la herramienta “Mini Nutritional Assessment – Short Form (MNA-SF)”. Además, si los profesionales vienen ejecutando otras herramientas que dominan podrían continuar con su aplicación.
A continuación, se describen los puntos de corte para definir “riesgo de desnutrición” con cada herramienta:
- Herramienta MUST: ≥ 1
- Herramienta MST: ≥ 2
- Herramienta MNA-SF: ≤ 11

BPC 3:
En el paciente que permanece hospitalizado por más de 7 días, repetir el tamizaje semanalmente y en caso de los pacientes ambulatorios o pacientes vistos en su domicilio, repetir el tamizaje ante algún síntoma o signo clínico (pérdida de peso involuntario, pérdida de apetito, anemia u otros).
BPC 4:
Los pacientes identificados con riesgo nutricional deben ser referidos para la evaluación nutricional e intervención inmediata.
BPC 5:
Los pacientes identificados con riesgo nutricional serán sometidos a la evaluación nutricional (se considerará principalmente el parámetro antropométrico, la composición corporal [Según disponibilidad de los instrumentos, evaluar pliegue cutáneo tricipital (PCT), circunfeencia media de brazo (CMB) u otra medición], bioquímico, y dietético). Esto permitirá realizar el diagnóstico de desnutrición.
2. Soporte nutricional
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos hospitalizados o ambulatorios con riesgo de desnutrición o diagnosticados como desnutridos, sugerimos ofrecer soporte nutricional (asesoramiento dietético, enriquecimiento de alimentos, suplementación nutricional oral, nutrición enteral y/o parenteral, según se requiera). (Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
El equipo de soporte nutricional es multidisciplinario, prioriza un trabajo conjunto con los pacientes, con los pacientes, los familiares, los cuidadores, el servicio de nutrición y los médicos tratantes; para prevenir o tratar la desnutrición según sea necesario.
3. Manejo nutricional
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En pacientes gravemente enfermos o con condiciones clínicas que requieran nutrición enteral por sonda o nutrición parenteral (con ayuno prolongado), considere lo siguiente para el soporte nutricional:
- De manera previa valorar los electrolitos como fósforo (signo cardinal), magnesio, potasio y calcio.
- Iniciar soporte nutricional con precaución, no más del 50% del objetivo energético y proteico estimado. Este debe ser construido para satisfacer todas las necesidades durante las primeras 24 a 48 horas, según metabolismo y tolerancia gastrointestinal.
- Administrar los requerimientos completos de líquidos, electrolitos (según los resultados de laboratorio), multivitamínicos y minerales desde el comienzo de la alimentación.
BPC 2:
Los pacientes con nada o muy poca ingesta de alimentos durante > 5 días tienen cierto riesgo de problemas de realimentación. En ellos, considere lo siguiente:
- Evitar la hidratación inicial en estos pacientes con dextrosa para prevenir el desarrollo del síndrome de Wernicke-Korsakoff.
- Para el soporte nutricional de pacientes en los que se observa ausencia de problemas de realimentación, según la clínica y el control bioquímico, considere introducir un máximo del 50% del requerimiento nutricional durante los primeros 2 días, y posteriormente brindar el requerimiento total para satisfacer sus necesidades.
BPC 3:
Considerar en alto riesgo de desarrollar síndrome de realimentación, a las personas que cumplan con uno o más de los siguientes criterios:
- IMC < 16 kg/m2.
- Pérdida de peso involuntaria superior al 15% en los últimos 3 a 6 meses.
- Poca o ninguna ingesta nutricional durante más de 5 días.
- Niveles bajos de potasio, fósforo o magnesio antes de la alimentación.
- Problemas gastrointestinales, vómito recurrente.
O a las personas que cumplan dos o más de los siguientes criterios:
- IMC < 18,5 kg/m2.
- Pérdida de peso involuntaria superior al 10% en los últimos 3 a 6 meses.
- Antecedentes de abuso de alcohol o drogas, incluidos insulina, quimioterapia, antiácidos o diuréticos.
- Problemas gastrointestinales, vómito recurrente.
BPC 4:
Las personas con alto riesgo de desarrollar problemas de realimentación deberán ser atendidas por profesionales de la salud debidamente capacitados y con un conocimiento profundo sobre requerimiento nutricional y soporte nutricional.
BPC 5:
Para el soporte nutricional en personas con alto riesgo de desarrollar síndrome realimentación, se debe considerar lo siguiente:
- Iniciar el soporte nutricional con el 25% de las calorías estimadas para el paciente. El aporte calórico se irá aumentando paulatinamente hasta llegar a la meta calórica a los 3 a 5 días.
- Realizar una distribución calórica equilibrada: 50-60% carbohidratos, 30-40% lípidos, y 15-20% de proteínas.
- La progresión del soporte nutricional debe ser vigilada y diaria, por lo que, de no conseguir el objetivo nutricional del 50% a los 3 o 5 días, solicitar interconsulta al equipo de soporte nutricional para iniciar nutrición parenteral.
- En casos extremos (por ejemplo, IMC < 14 kg/m2 o con ingesta insignificante durante más de 15 días) utilizar solo 5 kcal/kg/día y, monitorear el ritmo cardíaco continuamente en estas personas.
- Restaurar el volumen circulatorio, y monitorizar el equilibrio de líquidos y el estado clínico general de cerca.
- Proporcionar inmediatamente antes y durante los primeros 10 días de alimentación: multivitamínicos y elementos traza suplementarios una vez al día, de acuerdo con el dosaje en suero.
- Proveer suplementos de potasio, fósforo y magnesio según el requerimiento del paciente, después de realizar la evaluación de los niveles bioquímicos de los mismos.
- Para disminuir el riesgo de desarrollar el síndrome de Wernicke-Korsakoff, evitar el uso de dextrosa, cual sea su concentración.
- En pacientes no alcohólicos con sospecha o riesgo de síndrome de Wernicke Korsakoff, administrar como tratamiento profiláctico tiamina de 100 a 200 mg c/6h en bolo IV (o IM si IV no es posible) durante 3 a 5 días, seguidos de tiamina oral 100 mg c/8h durante 1 a 2 semanas y 100 mg diarios a partir de entonces.
- En pacientes alcohólicos con diagnóstico definitivo de síndrome de Wernicke-Korsakoff administrar tiamina de 200 a 500 mg c/8h IV durante 5 a 7 días, seguidos de tiamina oral 100 mg c/8h durante 1 a 2 semanas, posteriormente 100 mg diarios a partir de entonces.
4. Asesoramiento y suplementación
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos hospitalizados con riesgo de desnutrición o con diagnóstico de desnutrición, quienes tengan el tracto gastrointestinal funcional y accesible, sugerimos ofrecer asesoramiento dietético y suplemento nutricional oral. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
A las personas adultas hospitalizados con riesgo de desnutrición o con diagnóstico de desnutrición, que puedan deglutir, se puede ofrecer suplemento nutricional oral cuando el asesoramiento dietético y el enriquecimiento de los alimentos no sean suficientes para aumentar la ingesta dietética y alcanzar los objetivos nutricionales.
BPC 2:
En estos casos, el nutricionista debe asegurar que el aporte global de nutrientes del suplemento nutricional oral ofrecido contenga macro y micronutrientes específicos en las cantidades necesarias para la patología y condición del paciente. Asimismo, considerar el tipo, el sabor, la textura y el momento de consumo del suplemento nutricional oral para adaptarlo a la condición clínica y a la capacidad alimentaria del paciente.
BPC 3:
En los adultos mayores, tras el alta hospitalaria se podría ofrecer suplemento nutricional oral para continuar con la mejora de la ingesta dietética, el peso corporal, reducir el riesgo de deterioro funcional y prevenir el reingreso hospitalario.
BPC 4:
Considerar la continuidad del suplemento nutricional oral de manera periódica (a nivel hospitalario, ambulatorio y/o domiciliario), tomando en cuenta la evaluación del cumplimiento, la tolerancia, condición clínica del paciente.
BPC 5:
El suplemento nutricional oral debe suspenderse cuando el paciente haya establecido una ingesta oral adecuada (consumo de por lo menos 70% de los requerimientos) y haya mejorado sus indicadores nutricionales y bioquímicos.
5. Soporte nutricional enteral
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos con diagnóstico de desnutrición hospitalizados con ingesta oral insuficiente (menos del 60%) y un tracto gastrointestinal funcional y accesible, recomendamos brindar soporte nutricional enteral en lugar de la atención estándar. (Recomendación fuerte a favor, certeza baja de la evidencia)
Recomendación 2:
En pacientes adultos con diagnóstico de desnutrición dados de alta hospitalaria con ingesta oral insuficiente (menos del 60%) y un tracto gastrointestinal funcional y accesible, recomendamos continuar con el soporte nutricional enteral en el hogar en lugar de la atención estándar. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BCP 1:
Se ofrecerá soporte nutricional enteral cuando: la ingesta oral sea imposible durante más de tres días, o se encuentre por debajo del 60% de los requerimientos nutricionales durante más de una semana, a pesar de las intervenciones para asegurar una ingesta oral adecuada.
BCP 2:
Está indicada la nutrición enteral por sonda en: pacientes en estado de inconciencia (traumatismo craneoencefálico, en ventilación mecánica), trastorno de deglución neuromuscular (Post-ACV, esclerosis múltiple, enfermedad de la neurona motora, enfermedad de Parkinson, miastenia gravis, parálisis cerebral, esclerosis lateral amiotrófica), anorexia fisiológica (cáncer, sepsis, enfermedad hepática, VIH), obstrucción gastrointestinal superior (estenosis o tumor orofaríngeo o esofágico), disfunción gastrointestinal o malabsorción (dismotilidad, enfermedad inflamatoria intestinal, longitud del intestino reducida aunque puede ser necesaria nutrición parenteral), aumento de las necesidades nutricionales (fibrosis quística, quemaduras), problemas psicológicos (depresión severa o anorexia nerviosa), tratamiento específico (enfermedad inflamatoria intestinal, tuberculosis [pulmonar, gastrointestinal o sistémica], lesiones por presión (a partir de grado II)), pacientes con COVID-19 moderado o en pacientes con problemas de salud mental (demencia, Alzheimer).
BPC 3:
Las personas en medicina general, cirugía y cuidados intensivos, con desnutrición o en riesgo de desnutrición con ingesta oral insuficiente (menos del 60%), y con tracto gastrointestinal funcional y accesible, proveer soporte nutricional enteral mediante una sonda enteral (nasogástrica, duodenal o yeyunal). En caso de un tracto gastrointestinal superior disfuncional se debe considerar alimentación enteral a través de ostomías (gastrostomías o yeyunostomías).
BPC 4:
En pacientes con disfagia que necesiten soporte nutricional enteral a largo plazo (de 4 semanas a más) considerar la alimentación por gastrostomía.
BPC 5:
Después de un accidente cerebrovascular, las personas que no pueden tragar con seguridad o cubrir sus requerimientos nutricionales por vía oral, deben ser evaluados inicialmente para el soporte nutricional enteral por sonda nasogástrica y de necesitar nutrición enteral por más de 5 semanas considerar el uso de gastrostomía.
BPC 6:
En pacientes quirúrgicos que están desnutridos y con ingesta oral insuficiente (menos del 60%) y un tracto gastrointestinal funcional y accesible, que serán sometidos a procedimientos abdominales importantes, se debe considerar tratamiento enteral preoperatorio mediante sonda nasogástrica y/o naso yeyunal.
BPC 7:
Los pacientes en cirugía general post-operados pueden tener soporte nutricional enteral temprana o precoz por sonda nasogástrica y/o naso yeyunal según evaluación e indicación, para asegurar su requerimiento nutricional.
6. Nutrición enteral por sonda
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En pacientes adultos en riesgo de desnutrición o diagnosticados como desnutridos que reciben nutrición enteral (NE), optar por las modalidades de infusión continua o intermitente teniendo en cuenta la condición clínica, tolerancia, la comodidad del paciente y la administración de las medicinas.
BPC 2:
En pacientes adultos en cuidados intensivos que reciben nutrición enteral (NE), por lo general se debe administrar dicha alimentación de forma continua durante 20 horas netas a diario en lugar de intermitente. Si se necesita la administración de insulina, es más seguro y práctico administrar la nutricional de forma continua durante 24 horas.
7. Agentes procinéticos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con nutrición enteral por sonda, en cuidados intensivos, recomendamos indicar el uso de agentes procinéticos. (Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
Considere los agentes procinéticos como por ejemplo metoclopramida 10mg IV cada 8h durante 5 días, por sonda durante 5 días.
BPC 2:
Considere que las dosis propuestas están sujetas a evaluación de comorbilidades del paciente como insuficiencia renal.
BPC 3:
Considere la alimentación por sonda enteral pospilórica y/o nutrición parenteral, en caso de que a pesar del uso de agentes procinéticos persista el retraso del vaciamiento gástrico, lo cual limitaría gravemente la nutrición en el estómago.
8. Nutrición parenteral total
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos desnutridos sometidos a procedimientos quirúrgicos, sugerimos brindar nutrición parenteral total. (Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
En los pacientes desnutridos sometidos a procedimientos quirúrgicos, considere brindar nutrición parenteral total en:
- Aquellos con ingesta nutricional oral y/o enteral insuficiente (menos del 60%).
- Aquellos con el tracto gastrointestinal no funcional, inaccesible o con falta de continuidad.
- Aquellos con tratamiento de fístula gastrointestinal de alto gasto > 500 ml/ día.
- Aquellos con íleo posquirúrgico prolongado > 500 ml de residuo.
- Aquellos con ostomías menores a 100 cm del ángulo de Treitz, o complicaciones con la sonda de alimentación.
BPC 2:
En los pacientes desnutridos sometidos a procedimientos quirúrgicos, considere brindar soporte nutrición parenteral complementaria cuando ingieren por vía enteral menos del 60% de su requerimiento nutricional:
- Aquellos con capacidad de absorción inadecuada (síndrome del intestino corto).
- Aquellos con malabsorción (enfermedad inflamatoria intestinal, enteritis por radiación).
- Aquellos con enfermedades subyacentes con dismotilidad crónica (pseudoobstrucción crónica, pseudocolitis membranosa refractaria, diarrea refractaria).
BPC 3:
La nutrición parenteral debe introducirse de forma progresiva usualmente no mayor del 50% del requerimiento nutricional durante las primeras 24 a 48 h, y debe ser monitoreada diariamente.
BPC 4:
Los requerimientos nutricionales se ajustarán a la situación de estrés del paciente.
Habitualmente, ante un paciente quirúrgico que ingresa en la unidad de cuidados intensivos que se encuentra en fase catabólica, se administrarán 20-25 kcal/kg/día y se aumentará a 25-30 kcal/kg/día en la fase anabólica.
BPC 5:
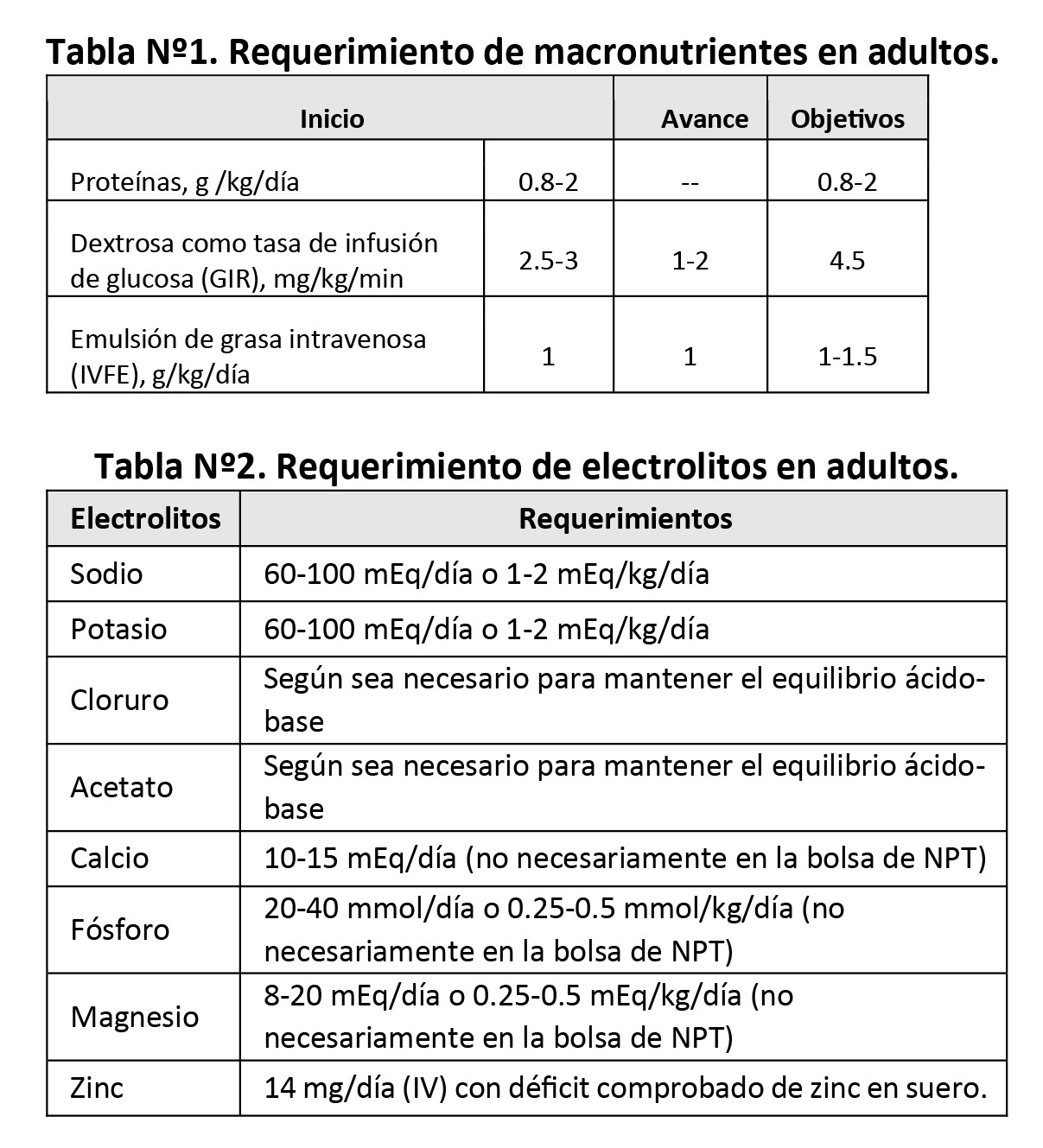
Para el inicio y avance de macronutrientes en los adultos, seguir los requerimientos detallados en la Tabla Nº1.
Considere los requerimientos de electrolitos en los pacientes adultos, detallados en la Tabla Nº2.
BPC 6:
En los pacientes con comorbilidad como la insuficiencia renal, considere iniciar los requerimientos de electrolitos al 50%.
BPC 7:
Realizar monitoreo mediante pruebas de laboratorio diario en los pacientes con enfermedad crítica: conteo sanguíneo completo con diferencial (semanal), creatinina, triglicéridos, pruebas de función hepática, electrolitos, glucosa, glucosa en sangre capilar (cada 6h), magnesio, fósforo.
BPC 8:
La nutrición parenteral se suspende cuando el paciente tolera más del 60% de sus requerimientos nutricionales, sea por vía oral o enteral. La suspensión debe planificarse, con una revisión diaria del progreso del paciente. No hay un período mínimo de tiempo para la duración de la nutrición parenteral.
9. Monitorización de parámetros nutricionales
Descargar PDF con el desarrollo de la pregunta.
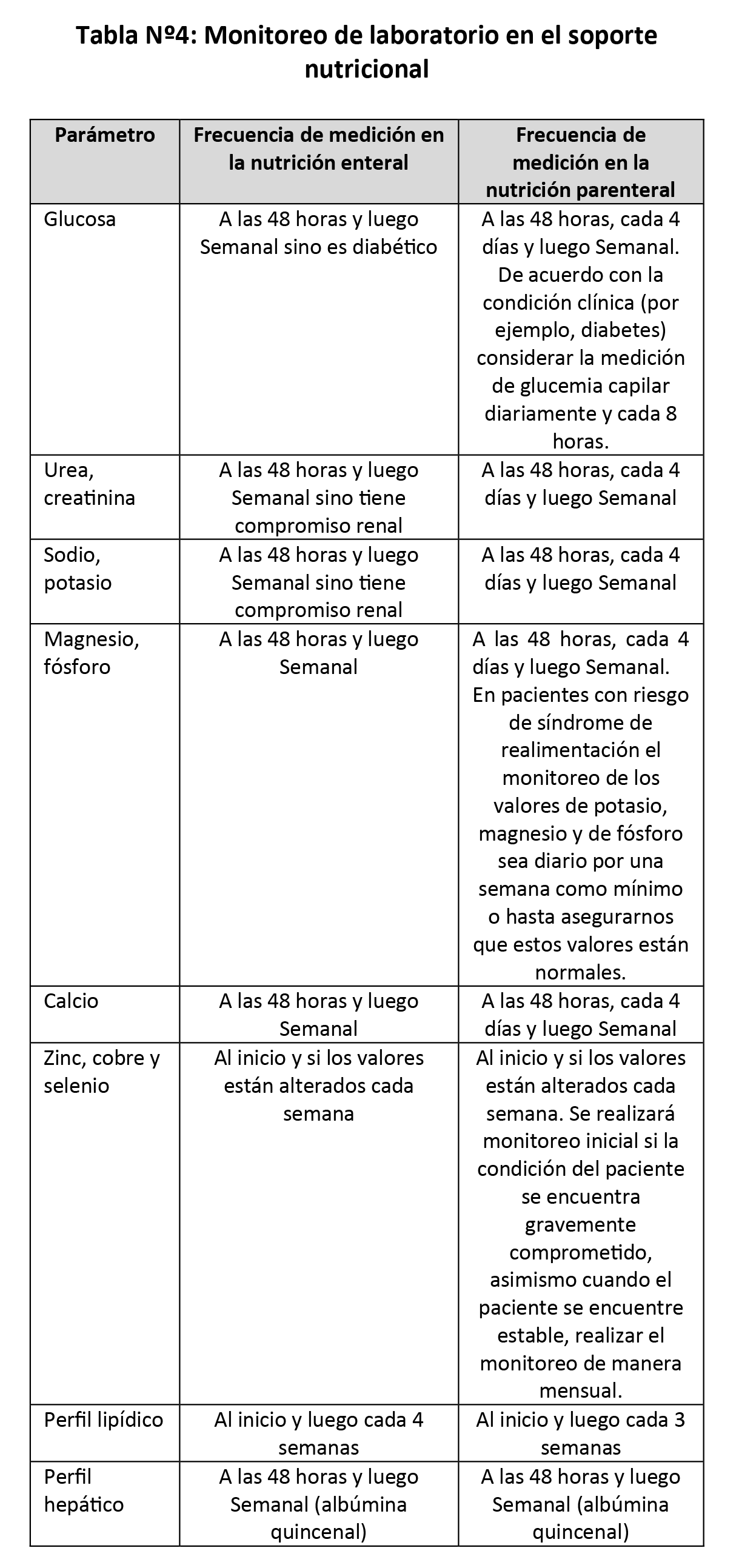
BPC 1:
En adultos hospitalizados con soporte nutricional enteral o parenteral, establecer la frecuencia de monitoreo de acuerdo con lo descrito en las tablas Nº 3 y Nº4.
Asimismo, para la frecuencia tener en cuenta la naturaleza y severidad del estado de la enfermedad subyacente si es que previamente los resultados fueron anormales. Además, considerar la tolerancia del soporte nutricional, nivel del estrés metabólico, estado nutricional, progreso de los valores bioquímicos, entorno de la atención nutricional y la duración prevista del soporte nutricional.

BPC 2:
El monitoreo en el paciente ambulatorio con soporte nutricional oral y/o enteral será realizado por un profesional de la salud que sea parte del equipo de la Unidad de Soporte Nutricional, con entrenamiento y experiencia en el manejo de soporte nutricional. Estos pacientes serán monitorizados al mes de inicio, luego cada 2 o 3 meses y posteriormente cada 3 meses, o más frecuente si hay algún cambio en su condición clínica. Se considera realizar un número limitado de observaciones y/o pruebas referentes a la tabla Nº 3 referida anteriormente, además las pruebas de laboratorio generalmente no serán necesarias si el progreso clínico es satisfactorio.
BPC 3:
Se supervisará el progreso del paciente hacia los objetivos a corto y largo plazo definidos en el plan de intervención nutricional de acuerdo con los parámetros descritos en las tablas Nº3 y Nº4. Si no se cumplen los objetivos, se presenta un nuevo problema o complicación clínica y/o se produce un evento adverso, modificar el plan de intervención nutricional.
Referencias bibliográficas
- Elia M, Chairman and Editor. The MUST Report. Nutritional screening of adults: a multidisciplinary responsibility. Development and use of the ‘Malnutrition Universal Screening Tool’ (‘MUST’) for adults. In: Malnutrition Advisory Group (MAG) aSCoB, editor. 2003.
- Cederholm T, Jensen GL, Correia M, Gonzalez MC, Fukushima R, Higashiguchi T, et al. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clinical nutrition (Edinburgh, Scotland). 2019;38(1):1-9.
- Care NCCfA. Nutrition support in adults Oral nutrition support, enteral tube feeding and parenteral nutrition. In: London, editor. February 2006 [Updated 2017].
- Stratton R ST, Gabe S. Managing malnutrition to improve lives and save money. In: BAPEN, editor. 2018.
- Health Do. Nutrition screening and use of oral nutrition support for adults in the acute care setting. (NCEC National Clinical Guideline No. 22). 2020.
- Cardenas D, Bermúdez C, Pérez A, Diaz G, Cortes LY, Contreras CP, et al. Nutritional risk is associated with an increase of in-hospital mortality and a reduction of being discharged home: Results of the 2009–2015 nutritionDay survey. Clin Nutr ESPEN. 2020;38:138-45.
- Zeña-Huancas PA, Pajuelo-García D, Díaz-Vélez C. Factores asociados a desnutrición en pacientes hospitalizados en el servicio de cirugía de emergencia de un hospital del seguro social peruano. Acta Médica Peruana. 2020;37:278-84.
- Sze S, Pellicori P, Zhang J, Weston J, Clark AL. The impact of malnutrition on short-term morbidity and mortality in ambulatory patients with heart failure. Am J Clin Nutr. 2021;113(3):695-705.
- Thibault R, Abbasoglu O, Ioannou E, Meija L, Ottens-Oussoren K, Pichard C, et al. ESPEN guideline on hospital nutrition. Clinical Nutrition. 2021;40(12):5684-709.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Lochs H, Allison SP, Meier R, Pirlich M, Kondrup J, Schneider S, et al. Introductory to the ESPEN Guidelines on Enteral Nutrition: Terminology, definitions and general topics. Clinical nutrition (Edinburgh, Scotland). 2006;25(2):180-6.
- Braga M, Gianotti L, Nespoli L, Radaelli G, Di Carlo V. Nutritional approach in malnourished surgical patients: a prospective randomized study. Archives of surgery (Chicago, Ill : 1960). 2002;137(2):174-80.
- Wilson JM, Boissonneault AR, Schwartz AM, Staley CA, Schenker ML. Frailty and Malnutrition Are Associated With Inpatient Postoperative Complications and Mortality in Hip Fracture Patients. Journal of orthopaedic trauma. 2019;33(3):143-8.
- Nishiyama VKG, Albertini SM, Moraes C, Godoy MF, Netinho JG. MALNUTRITION AND CLINICAL OUTCOMES IN SURGICAL PATIENTS WITH COLORECTAL DISEASE. Arquivos de gastroenterologia. 2018;55(4):397-402.
- Fieber JH, Sharoky CE, Wirtalla C, Williams NN, Dempsey DT, Kelz RR. The Malnourished Patient With Obesity: A Unique Paradox in Bariatric Surgery. The Journal of surgical research. 2018;232:456-63.
- Mignini EV, Scarpellini E, Rinninella E, Lattanzi E, Valeri MV, Clementi N, et al. Impact of patients nutritional status on major surgery outcome. Eur Rev Med Pharmacol Sci. 2018;22(11):3524-33.
- Reber E, Gomes F, Vasiloglou MF, Schuetz P, Stanga Z. Nutritional Risk Screening and Assessment. J Clin Med. 2019;8(7):1065.
- Kirkland LL, Kashiwagi DT, Brantley S, Scheurer D, Varkey P. Nutrition in the hospitalized patient. Journal of hospital medicine. 2013;8(1):52-8.
- Harris PS, Payne L, Morrison L, Green SM, Ghio D, Hallett C, et al. Barriers and facilitators to screening and treating malnutrition in older adults living in the community: a mixed-methods synthesis. BMC Family Practice. 2019;20(1):100.
- Allard JP, Keller H, Jeejeebhoy KN, Laporte M, Duerksen DR, Gramlich L, et al. Malnutrition at Hospital Admission-Contributors and Effect on Length of Stay: A Prospective Cohort Study From the Canadian Malnutrition Task Force. JPEN Journal of parenteral and enteral nutrition. 2016;40(4):487-97.
- Lim SL, Ong KC, Chan YH, Loke WC, Ferguson M, Daniels L. Malnutrition and its impact on cost of hospitalization, length of stay, readmission and 3-year mortality. Clinical nutrition (Edinburgh, Scotland). 2012;31(3):345-50.
- Skipper A, Coltman A, Tomesko J, Charney P, Porcari J, Piemonte TA, et al. Adult Malnutrition (Undernutrition) Screening: An Evidence Analysis Center Systematic Review. Journal of the Academy of Nutrition and Dietetics. 2020;120(4):669-708.
- Cattani A, Eckert IC, Brito JE, Tartari RF, Silva FM. Nutritional risk in critically ill patients: how it is assessed, its prevalence and prognostic value: a systematic review. Nutrition reviews. 2020;78(12):1052-68.
- Cascio BL, Logomarsino JV. Evaluating the effectiveness of five screening tools used to identify malnutrition risk in hospitalized elderly: A systematic review. Geriatric nursing (New York, NY). 2018;39(1):95-102.
- Ruan X, Nakyeyune R, Shao Y, Shen Y, Niu C, Zang Z, et al. Nutritional screening tools for adult cancer patients: A hierarchical Bayesian latent-class meta-analysis. Clinical nutrition (Edinburgh, Scotland). 2021;40(4):1733-43.
- Elke G, Hartl WH, Kreymann KG, Adolph M, Felbinger TW, Graf T, et al. Clinical Nutrition in Critical Care Medicine – Guideline of the German Society for Nutritional Medicine (DGEM). Clin Nutr ESPEN. 2019;33:220-75.
- Volkert D, Beck AM, Cederholm T, Cruz-Jentoft A, Goisser S, Hooper L, et al. ESPEN guideline on clinical nutrition and hydration in geriatrics. Clinical nutrition (Edinburgh, Scotland). 2019;38(1):10-47.
- De Groot LM, Lee G, Ackerie A, van der Meij BS. Malnutrition Screening and Assessment in the Cancer Care Ambulatory Setting: Mortality Predictability and Validity of the Patient-Generated Subjective Global Assessment Short form (PG-SGA SF) and the GLIM Criteria. Nutrients. 2020;12(8):2287.
- Skipper A, Coltman A, Tomesko J, Charney P, Porcari J, Piemonte TA, et al. Position of the Academy of Nutrition and Dietetics: Malnutrition (Undernutrition) Screening Tools for All Adults. Journal of the Academy of Nutrition and Dietetics. 2020;120(4):709-13.
- Ferguson M, Capra S, Bauer J, Banks M. Development of a valid and reliable malnutrition screening tool for adult acute hospital patients. Nutrition (Burbank, Los Angeles County, Calif). 1999;15(6):458-64.
- Elia M. THE ‘MUST’ REPORT Nutritional screening of adults: a multidisciplinary responsibility. In: BAPEN MAGASo, editor. 2003.
- Rubenstein LZ, Harker JO, Salvà A, Guigoz Y, Vellas B. Screening for undernutrition in geriatric practice: developing the short-form mini-nutritional assessment (MNA-SF). The journals of gerontology Series A, Biological sciences and medical sciences. 2001;56(6):M366-72.
- Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clinical nutrition (Edinburgh, Scotland). 2019;38(1):48-79.
- Cederholm T, Bosaeus I, Barazzoni R, Bauer J, Van Gossum A, Klek S, et al. Diagnostic criteria for malnutrition – An ESPEN Consensus Statement. Clinical Nutrition. 2015;34(3):335-40.
- República Dominicana MdS. Protocolo de manejo nutricional del paciente con cirrosis hepática descompensada. 2018.
- Campos del Portillo R, Palma MiIla S, García Váquez N, Plaza López B, Bermejo López L, Riobó Serván P, et al. Assessment of nutritional status in the healthcare setting in Spain. Nutr Hosp. 2015;31 Suppl 3:196-208.
- Lluch-Taltavull J, Mercadal-Orfila G, Afonzo-Gobbi YS. Mejora de la situación nutricional y la calidad de vida de los pacientes oncológicos mediante protocolo de evaluación y de intervención nutricional. Nutrición Hospitalaria. 2018;35:606-11.
- Gill A, Givi B, Moore MG. AHNS Series – Do you know your guidelines?: Assessment and management of malnutrition in patients with head and neck cancer: Review of the NCCN Clinical Practice Guidelines In Oncology (NCCN Guidelines). Head & Neck. 2019;41(3):577-83.
- Álvaro Sanz E, Abilés J, Garrido Siles M, Rivas Ruíz F, Tortajada Goitia B, Domínguez AR. Evaluation of a protocol to detect malnutrition and provide nutritional care for cancer patients undergoing chemotherapy. Sci Rep. 2020;10(1):21186.
- Stratton RJ, Elia M. Who benefits from nutritional support: what is the evidence? European Journal of Gastroenterology & Hepatology. 2007;19(5):353-8.
- Koretz RL, Avenell A, Lipman TO, Braunschweig CL, Milne AC. Does enteral nutrition affect clinical outcome? A systematic review of the randomized trials. The American journal of gastroenterology. 2007;102(2):412-29; quiz 68.
- Koretz RL, Lipman TO. The presence and effect of bias in trials of early enteral nutrition in critical care. Clinical nutrition (Edinburgh, Scotland). 2014;33(2):240-5.
- Bally MR, Blaser Yildirim PZ, Bounoure L, Gloy VL, Mueller B, Briel M, et al. Nutritional Support and Outcomes in Malnourished Medical Inpatients: A Systematic Review and Meta-analysis. JAMA Intern Med. 2016;176(1):43-53.
- Gomes F, Baumgartner A, Bounoure L, Bally M, Deutz NE, Greenwald JL, et al. Association of Nutritional Support With Clinical Outcomes Among Medical Inpatients Who Are Malnourished or at Nutritional Risk: An Updated Systematic Review and Meta-analysis. JAMA Netw Open. 2019;2(11):e1915138.
- Merker M, Felder M, Gueissaz L, Bolliger R, Tribolet P, Kägi-Braun N, et al. Association of Baseline Inflammation With Effectiveness of Nutritional Support Among Patients With Disease-Related Malnutrition: A Secondary Analysis of a Randomized Clinical Trial. JAMA Netw Open. 2020;3(3):e200663-e.
- Schuetz P, Sulo S, Walzer S, Vollmer L, Brunton C, Kaegi-Braun N, et al. Cost savings associated with nutritional support in medical inpatients: an economic model based on data from a systematic review of randomised trials. BMJ Open. 2021;11(7):e046402.
- Kaegi-Braun N, Mueller M, Schuetz P, Mueller B, Kutz A. Evaluation of Nutritional Support and In-Hospital Mortality in Patients With Malnutrition. JAMA Netw Open. 2021;4(1):e2033433.
- Rasmussen NML, Belqaid K, Lugnet K, Nielsen AL, Rasmussen HH, Beck AM. Effectiveness of multidisciplinary nutritional support in older hospitalised patients: A systematic review and meta-analyses. Clin Nutr ESPEN. 2018;27:44-52.
- Mehanna HM, Moledina J, Travis J. Refeeding syndrome: what it is, and how to prevent and treat it. BMJ. 2008;336(7659):1495-8.
- So YT. Wernicke encephalopathy2020. Available from: https://bibvirtual.upch.edu.pe:2050/contents/wernicke-encephalopathy?search=wernicke%20korsakoff&source=search_result&selectedTitle=1~64&usage_type=default&display_rank=1#references.
- Latt N, Dore G. Thiamine in the treatment of Wernicke encephalopathy in patients with alcohol use disorders. Internal medicine journal. 2014;44(9):911-5.
- Mehler PS, Winkelman AB, Andersen DM, Gaudiani JL. Nutritional rehabilitation: practical guidelines for refeeding the anorectic patient. Journal of nutrition and metabolism. 2010;2010.
- Koguchi K, Nakatsuji Y, Abe K, Sakoda S. Wernicke’s encephalopathy after glucose infusion. Neurology. 2004;62(3):512-.
- Gárdián G, Vörös E, Járdánházy T, Ungureán A, Vécsei L. Wernicke’s encephalopathy induced by hyperemesis gravidarum. Acta neurologica Scandinavica. 1999;99(3):196-8.
- Spruill SC, Kuller JA. Hyperemesis gravidarum complicated by Wernicke’s encephalopathy. Obstetrics and gynecology. 2002;99(5 Pt 2):875-7.
- Temprano J BI, Cuerda C, Camblor M, Zugasti A, García P. Síndrome de realimentación. 2005;205(2):79-86.
- Fernández López MT, López Otero MJ, Álvarez Vázquez P, Arias Delgado J, Varela Correa JJ. Síndrome de realimentación. Farmacia Hospitalaria. 2009;33(4):183-93.
- Crook MA, Hally V, Panteli JV. The importance of the refeeding syndrome1 1Disclaimer: It is recommended that readers check drug and electrolyte dosages and concentrations with their pharmacies before patient administration. The authors accept no responsibility for errors in the article. Nutrition (Burbank, Los Angeles County, Calif). 2001;17(7):632-7.
- Stratton RJ GC, Elia M Disease‐Related Malnutrition: an Evidence‐Based Approach to Treatment. Wallingford, UK: CABI. 2003.
- Baldwin C, Parsons TJ. Dietary advice and nutritional supplements in the management of illness-related malnutrition: systematic review. Clinical nutrition (Edinburgh, Scotland). 2004;23(6):1267-79.
- Baldwin C, Weekes CE. Dietary advice with or without oral nutritional supplements for disease-related malnutrition in adults. Cochrane Database Syst Rev. 2011;2011(9):Cd002008.
- Baldwin C, Weekes CE. Dietary counselling with or without oral nutritional supplements in the management of malnourished patients: a systematic review and meta-analysis of randomised controlled trials. Journal of human nutrition and dietetics : the official journal of the British Dietetic Association. 2012;25(5):411-26.
- Elia M SR, Russell C, Green C, Pang F. The cost of disease-related malnutrition in the UK and economic considerations for the use of oral nutritional supplements (ONS) in adults. A report by the Health Economic Group of The British Association for Parenteral and Enteral Nutrition (BAPEN). BAPEN.2021.
- Bischoff SC, Austin P, Boeykens K, Chourdakis M, Cuerda C, Jonkers-Schuitema C, et al. ESPEN guideline on home enteral nutrition. Clinical nutrition (Edinburgh, Scotland). 2020;39(1):5-22.
- D S. Nutrition support in critically ill patients: Enteral nutrition.
- Ojo O, Keaveney E, Wang XH, Feng P. The Effect of Enteral Tube Feeding on Patients’ Health-Related Quality of Life: A Systematic Review. Nutrients. 2019;11(5).
- Feinberg J, Nielsen EE, Korang SK, Halberg Engell K, Nielsen MS, Zhang K, et al. Nutrition support in hospitalised adults at nutritional risk. Cochrane Database Syst Rev. 2017;5(5):Cd011598.
- Zeng J, Hu J, Chen Q, Feng J. Home enteral nutrition’s effects on nutritional status and quality of life after esophagectomy. Asia Pacific journal of clinical nutrition. 2017;26(5):804-10.
- Bowrey DJ, Baker M, Halliday V, Thomas AL, Pulikottil-Jacob R, Smith K, et al. A randomised controlled trial of six weeks of home enteral nutrition versus standard care after oesophagectomy or total gastrectomy for cancer: report on a pilot and feasibility study. Trials. 2015;16:531.
- Freijer K, Bours MJ, Nuijten MJ, Poley MJ, Meijers JM, Halfens RJ, et al. The economic value of enteral medical nutrition in the management of disease-related malnutrition: a systematic review. Journal of the American Medical Directors Association. 2014;15(1):17-29.
- Wong A, Goh G, Banks MD, Bauer JD. A systematic review of the cost and economic outcomes of home enteral nutrition. Clinical nutrition (Edinburgh, Scotland). 2018;37(2):429-42.
- Tatsumi H. Enteral tolerance in critically ill patients. Journal of intensive care. 2019;7(1):30.
- Hu B, Sun R, Wu A, Ni Y, Liu J, Guo F, et al. Prognostic Value of Prolonged Feeding Intolerance in Predicting All-Cause Mortality in Critically Ill Patients: A Multicenter, Prospective, Observational Study. JPEN Journal of parenteral and enteral nutrition. 2020;44(5):855-65.
- Bear DE, Hart N, Puthucheary Z. Continuous or intermittent feeding: pros and cons. Current opinion in critical care. 2018;24(4):256-61.
- Hooper MH, Marik PE. Controversies and Misconceptions in Intensive Care Unit Nutrition. Clinics in chest medicine. 2015;36(3):409-18.
- Marik PE. Feeding critically ill patients the right ‘whey’: thinking outside of the box. A personal view. Ann Intensive Care. 2015;5(1):51.
- Ichimaru S, Amagai T. Intermittent and Bolus Methods of Feeding in Critical Care. In: Rajendram R, Preedy VR, Patel VB, editors. Diet and Nutrition in Critical Care. New York, NY: Springer New York; 2014. p. 1-17.
- Zhu W, Jiang Y, Li J. Intermittent versus continuous tube feeding in patients with hemorrhagic stroke: a randomized controlled clinical trial. European journal of clinical nutrition. 2020;74(10):1420-7.
- McNelly AS, Bear DE, Connolly BA, Arbane G, Allum L, Tarbhai A, et al. Effect of Intermittent or Continuous Feed on Muscle Wasting in Critical Illness: A Phase 2 Clinical Trial. Chest. 2020;158(1):183-94.
- Ma Y, Cheng J, Liu L, Chen K, Fang Y, Wang G, et al. Intermittent versus continuous enteral nutrition on feeding intolerance in critically ill adults: A meta-analysis of randomized controlled trials. International journal of nursing studies. 2021;113:103783.
- Patel JJ, Rosenthal MD, Heyland DK. Intermittent versus continuous feeding in critically ill adults. Current opinion in clinical nutrition and metabolic care. 2018;21(2):116-20.
- Peng R, Li H, Yang L, Zeng L, Yi Q, Xu P, et al. The efficacy and safety of prokinetics in critically ill adults receiving gastric feeding tubes: A systematic review and meta-analysis. PloS one. 2021;16(1):e0245317-e.
- Jiang Q-J, Jiang C-F, Chen Q-T, Shi J, Shi B. Erythromycin for Promoting the Postpyloric Placement of Feeding Tubes: A Systematic Review and Meta-Analysis. Gastroenterol Res Pract. 2018;2018:1671483-.
- Liu Y, Dong X, Yang S, Wang A, Wang M. Metoclopramide for preventing nosocomial pneumonia in patients fed via nasogastric tubes: a systematic review and meta-analysis of randomized controlled trials. Asia Pacific journal of clinical nutrition. 2017;26(5):820-8.
- Lewis K, Alqahtani Z, McIntyre L, Almenawer S, Alshamsi F, Rhodes A, et al. The efficacy and safety of prokinetic agents in critically ill patients receiving enteral nutrition: a systematic review and meta-analysis of randomized trials. Critical care (London, England). 2016;20(1):259.
- Booth CM, Heyland DK, Paterson WG. Gastrointestinal promotility drugs in the critical care setting: a systematic review of the evidence. Critical care medicine. 2002;30(7):1429-35.
- sanitarios AEdMyP. Ficha tecnica metoclopramida accord 10 mg comprimidos EFG [Available from: https://cima.aemps.es/cima/dochtml/ft/75665/FT_75665.html.
- Heyland DK, Montalvo M, MacDonald S, Keefe L, Su XY, Drover JW. Total parenteral nutrition in the surgical patient: a meta-analysis. Canadian journal of surgery Journal canadien de chirurgie. 2001;44(2):102-11.
- Ganaie AR, Itoo MS, Bhat GM. Effects of perioperative parenteral nutrition on wound healing and hospital stay in surgical patients: a randomized controlled study. International Journal of Research in Medical Sciences. 2015;3:3156-60.
- Group VATPNCS. Perioperative total parenteral nutrition in surgical patients. N Engl J Med. 1991;325(8):525-32.
- Gribovskaja-Rupp I, Melton GB. Enterocutaneous Fistula: Proven Strategies and Updates. Clin Colon Rectal Surg. 2016;29(2):130-7.
- Polk TM, Schwab CW. Metabolic and nutritional support of the enterocutaneous fistula patient: a three-phase approach. World journal of surgery. 2012;36(3):524-33.
- Blakely AM, Ajmal S, Sargent RE, Ng TT, Miner TJ. Critical analysis of feeding jejunostomy following resection of upper gastrointestinal malignancies. World J Gastrointest Surg. 2017;9(2):53-60.
- Pironi L, Arends J, Baxter J, Bozzetti F, Peláez RB, Cuerda C, et al. ESPEN endorsed recommendations. Definition and classification of intestinal failure in adults. Clinical nutrition (Edinburgh, Scotland). 2015;34(2):171-80.
- Sánchez Álvarez C, Zabarte Martínez de Aguirre M, Bordejé Laguna L. Guidelines for specialized nutritional and metabolic support in the critically-ill patient: Update. Consensus SEMICYUC-SENPE: Gastrointestinal surgery. Nutrición Hospitalaria. 2011;26:41-5.
- (A.S.P.E.N.) ASfPaEN. Parenteral Nutrition Handbook. Edition n, editor2014.
- Kraft MD, Btaiche IF, Sacks GS, Kudsk KA. Treatment of electrolyte disorders in adult patients in the intensive care unit. American journal of health-system pharmacy : AJHP : official journal of the American Society of Health-System Pharmacists. 2005;62(16):1663-82.
- (A.S.P.E.N.) ASfPaEN. Adult Nutrition Support Core Curriculum, . Edition n, editor2012.
- Şimşek T, Şimşek HU, Cantürk NZ. Response to trauma and metabolic changes: posttraumatic metabolism. Ulus Cerrahi Derg. 2014;30(3):153-9.
- McClave SA, DiBaise JK, Mullin GE, Martindale RG. ACG Clinical Guideline: Nutrition Therapy in the Adult Hospitalized Patient. The American journal of gastroenterology. 2016;111(3):315-34; quiz 35.
- Ukleja A, Gilbert K, Mogensen KM, Walker R, Ward CT, Ybarra J, et al. Standards for Nutrition Support: Adult Hospitalized Patients. Nutrition in Clinical Practice. 2018;33(6):906-20.
- S A. Basics in clinical nutrition: Monitoring of nutritional support, clinical monitoring. Clin Nutr ESPEN. 2009;4(5):E229-E30.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo a ietsi.gpc@gmail.com

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com